GCP的原则与内容(Good),即药物临床试验质量管理规范
GCP(Good),即良好临床试验实践,是对临床试验过程的标准规范,包括方案设计、组织实施、监测、审核、记录、分析、总结和报告。 其目的是保证药物临床试验过程规范、结果科学可靠,保护受试者权益、确保安全。
1、GCP的发展历程
19世纪末化学制药工业的兴起,开创了化学品开始应用于临床治疗的新时代。 大量新药的上市,一方面改善了临床不必要使用的困境,但另一方面也出现了许多新问题。 由于对化学药物的不良反应缺乏足够的认识,药物在投放市场前并未经过严格的临床试验。 药物引起的严重不良反应日益增多,患者死亡人数大幅增加。
1938年,美国立法规定药品上市前必须经过临床试验,并成立FDA对药品进行监督管理。 1960年西欧的沙利度胺惨案,让世界各国更加重视药物的临床试验和安全评价; 1964年,第18届世界医学大会通过《赫尔辛基宣言》,提出保障受试者的权利和安全; 1970-1990 20世纪90年代,全球许多国家颁布并实施了GCP。 此后,6个国家发起召开人用药品注册技术国际协调会议(ICH)食品分类系统,制定了一系列技术标准和指导原则。 世界卫生组织还颁布了《世界卫生组织《药物标准化临床试验指导原则》,我国于1998年首次颁布实施GCP,并于2003年进行了修订。
2.GCP的目的
1、保证测试科学、可靠;
2、确保工艺标准和规范;
3、受试者的权利和安全得到充分保障。
3. GCP参与架构及职责
GCP参与者主要包括①申办方,如药品生产企业、药品研究部门(如中科院药物研究所、各省市药物研究所等)、CRO(即合同研究组织) ,是为新药临床研究服务的中介机构)等:主管人员; ②药物临床试验机构:试验专业、试验地点、主要研究者、机构负责人; ③伦理委员会; ④ 国家食品药品监督管理局(SFDA); ⑤受试者,健康志愿者或患者。
一、主办方的职责
申办者是指申办临床试验并负责试验的启动、管理、财务和监控的公司、机构或组织。 申办者必须取得临床试验申请和批准文件,推荐临床试验单位候选人和研究者,认可其资格和条件,并提供研究者手册。 该试验将在获得SFDA临床试验批准和伦理委员会批准后开始。
申办者和研究者共同设计试验方案、知情同意书、病例报告表,并签署双方同意的试验方案和合同; 免费提供试用药物; 任命调查人员接受的合格监督员; 建立临床试验质量控制和质量保证体系; 与研究人员合作,迅速研究严重不良事件,采取措施确保受试者安全,并及时向药品监管部门报告,同时将不良事件通知涉及同一药物临床试验的其他研究人员。
申办者应当为参加临床试验的受试者提供保险,并为因试验而遭受损害或死亡的受试者承担治疗费用和相应的经济补偿。 申办者应当为研究者提供法律和经济保障,但因医疗事故造成的情况除外。 申办者提前终止或者暂停临床试验的,应当通知研究者、伦理委员会和国家药品监督管理局,并说明理由。
研究者进行临床试验时未遵守批准的方案或相关规定的,申办者应当指出并纠正。 情节严重或者研究者坚持改正的,应当终止研究者参加临床试验,并向药品监督管理部门报告。
监查员具有医学或药学背景,受过GCP培训,熟悉临床试验项目,是申办者和研究者之间的主要联系人。 监督的目的是保护受试者的权益,确保试验中记录和报告的数据准确、完整,确保试验符合方案、GCP和相关规定。
导师的监督内容主要包括:确定研究者是否符合研究条件和要求; 确认受试者在试验前是否签署知情同意书; 了解审判进展; 确认CRF与原始数据一致; 确认是否记录不良反应; 核实实验药品是否按规定供应。
2.研究员职责

主要研究者资格:具有医疗机构相应的专业技术职务和医疗资格; 具备试用计划所需的专业知识和经验; 具有临床试验经验或接受有经验的研究人员的指导; 熟悉申办者提供的信息以及与临床试验相关的信息和文件; 对参与试验的人员和试验使用所需设备的控制权。
主要研究者必须详细阅读和理解试验方案的内容,并严格遵守试验方案。 研究者必须按照申办者同意的方案实施试验; 该方案必须得到伦理委员会的批准; 研究者和申办者必须签署协议; 未经伦理委员会和申办者同意,研究者不得随意违反或修改方案,除非发生突然影响受试者安全的事件。 调查人员应记录并解释对方案的任何违反或修改。
在具有良好医疗设备、实验室设备、人员配备的医疗机构开展临床试验。 该机构拥有处理紧急情况的所有设施,以确保受试者的安全。 实验室检测结果应准确、可靠。 应征得当地医疗机构或主管部门同意,确保在规定时间内完成临床试验。 确保有足够数量的符合方案纳入标准的受试者进入临床试验。 您应该了解并熟悉研究药物的性质、作用、功效和安全性。 确保试验合作者熟悉试验相关信息。
首席研究员对试验药物的使用负责:首席研究员可以指派专人(药剂师或护士)监督试验药物的使用; 试验药品管理人员应当详细记录药品的领取、发放和归还情况。 这些记录应包括日期、数量、批号和有效期等; 试验用药物应当按照药品储存要求储存; 研究人员应确保研究药物仅用于受试者; 应指导受试者使用药物。
主要研究者应向受试者解释经伦理委员会批准的临床试验的详细情况并获得知情同意。 负责制定与临床试验相关的医疗决策,并确保受试者的不良事件得到适当的治疗。 确保受试者安全,及时报告严重不良事件,并采取适当的治疗措施。
研究者应在试验文件上签字,确保数据准确、完整、及时、合法地记录在病历和CRF中。 研究者确保CRF中的数据准确、完整、清晰、及时,并且CRF中的任何信息都有原始数据支持; CRF中的任何变更都应有日期、签名和解释,研究人员应保存试验相关文件直至药物上市。 5年后。
研究者需要接受申办者派出的监察员、审核员的监督以及药品监管部门的检查和检查,以保证临床试验的质量。 与申办者就临床试验的费用达成一致,并在合同中注明。 研究者不得向受试者使用实验药物收取费用。 测试完成后,必须撰写总结报告,签名并注明日期并发送给申办者。 临床试验提前终止或者暂停的,必须通知受试者、申办者、伦理委员会和国家药品监督管理局,并说明理由。
三、伦理委员会职责
伦理委员会应当保护受试者权益,保证试验的科学性、可靠性; 确保临床试验中受试者的权利和生命安全; 确保道德委员会的组成和运作公正; 工作应相对独立,不受任何试验参与者的影响; 道德委员会应有其工作程序,所有会议及其决议均应有记录。
伦理委员会组成:至少5人。 委员会成员有不同性别; 有从事非医学相关职业的工作者(法律专家); 有其他单位的委员会成员; 参加临床试验的成员不投票; 非会员专家不投票。
伦理委员会的职责应从保护受试者权益的角度严格审查方案:研究人员的资质和经验,以及是否有足够的时间参与临床试验。 试验方案是否适当,包括研究的目的、受试者和其他人员可能遭受的风险和益处以及试验设计的科学性。 受试者选择方式、知情同意书是否完整、易懂、获取知情同意书的方式是否恰当。 当受试者因参加临床试验而受到伤害甚至死亡时,伦理委员会有责任督促相关临床试验机构提供及时、有效的治疗,并督促申办者提供相应的治疗费用和经济补偿。 检查测试计划的拟议修订,看看它们是否可以接受。 定期审查正在进行的临床试验中受试者的风险水平。
伦理委员会收到申请后应尽快召开会议,审查讨论情况,出具书面意见,并附上出席会议成员名单、专业及签名。 批准文件应当附有计划编号和审查文件。 伦理委员会的意见主要包括:同意; 不同意; 进行必要的修改后同意; 终止或暂停已批准的试验。
{}
SOP的制定和实施
标准操作程序(SOP)是统一履行特定职责的详细书面说明。 制定SOP的意义在于保证临床试验按照GCP标准实施; 统一标准,规范行为,减少错误; 明确职责,工作有序,避免失误; 确保数据准确、结果可靠、保证质量。
1. 制定SOP的标准操作程序
制定SOP标准操作程序,即为SOP制定SOP,包括:①制定SOP; ② SOP的审核和批准; ③ 签发SOP; ④ SOP培训; ⑤ SOP的归档和保存; ⑥ SOP的修订; ⑦ 撤销SOP; ⑧ SOP编码原则。
1. SOP的制定
成立SOP编写小组和SOP质量保证小组。 SOP 编写团队首先制定临床试验机构管理和临床试验机构办公室职责范围内的 SOP。 然后,SOP编写团队为每个专业制定通用的SOP。 最后,SOP编写组根据专业设置划分相应的编写组,制定每个专业具体的SOP。
2. SOP的审核和批准
审查要点包括:是否符合现行法规,特别是药品临床试验质量管理规范; 是否按照文件系统框架的要求编写,编码是否正确; 是否实用; 术语是否一致; 语言是否会造成混乱; 及相关SOP是否会发生冲突; 文件系统是否完整。 SOP的“批准人”必须是临床试验机构的负责人。 临床试验机构负责人非法人的,仍应取得法人授权。
3. SOP的发行
SOP文件生效后,机构办公室将留存原件备案,并加盖红色“临床试验机构办公室”印章。 临床试验机构办公室按照范围和要求份数复印原件,分发给相关部门。 所有文件都将加盖红色印章。 《临床试验机构办公室》章。 所有SOP的分发和复制必须按照《临床试验文件管理系统》的要求进行相应记录。 所有未加盖印章的文件均被视为非法文件。
4.SOP培训
主要研究者和所有参与临床试验的人员必须事先接受完整的SOP培训。 机构办公室负责对医院相关临床试验人员进行本SOP的培训。
5. SOP的归档和保存
机构办公室保留完整的SOP原件,并根据文件的变化随时更新和记录。 每个专业部门和其他部门仅保留与本部门业务相关的SOP副本。 所有SOP不得随意复制。 各版本SOP的原始文件均存入机构档案室并永久保存。 在整个临床试验过程中,SOP必须分发给相关部门并存放在固定地点,以供随时参考。 SOP的归档和保存参照《临床试验文件管理系统》进行。
6. SOP的修订
以下情况需要对SOP进行补丁: ①最新的法律法规、技术标准、指南已经生效,现有的SOP与其不一致。 ②临床试验机构组织管理架构发生重大变化。 ③仪器设备和技术更新。 ④ 操作方法或流程发生重大变化。 ⑤ SOP实施和审核过程中,发现需要修改的重要问题。
各部门每年(一般为一年)定期总结SOP,提出修改建议,并向机关办公室提出书面申请。 经派出机构办公室主任批准后,方可组织修改。 (但尚需编写机构负责人批准后方可实施)。
7. 取消SOP
经批准撤回的文件,由机构办公室书面通知使用部门。 下发通知的同时,撤回的文件应予以撤回,不得出现在工作现场(中央档案室负责SOP的文件管理)。 撤回的旧版本除一份留机构档案备查外,其余副本均由机构办公室销毁。
8.SOP编码原则
①系统性:统一分类编码,体现文献的分类方法和级别。
②具体性:文件对应代码,一文本一代码。
③识别:编码应易于识别文件。
④可追溯性:从编码上可以追溯文件的演变历史。
⑤发展:为档案今后的发展和管理方法的改进预留空间。
⑥稳定性:编码体系一旦确定,不能随意更改,防止文件管理混乱。
⑦ 相关性:使用与文件内容相关的代号。
2. SOP的书写顺序
SOP的编写顺序是:
1、编写团队首先要制定组织管理的SOP;
2. 写作团队应制定所有专业通用的SOP;
3. 写作团队应制定每个专业独有的最终SOP。
3. SOP的分类
1、管理体系类。
机构管理体系SOP的例子包括:临床试验运行管理体系; 临床试验药品管理系统; 仪器设备管理系统; 临床试验人员培训管理系统; 临床试验文件管理系统; 临床试验合同管理系统; 临床试验财务管理系统; 研究人员的责任; 组织结构图; 数据管理系统; 质量主管等的职责
2.工作程序:某些临床试验具体工作方面的操作程序。
各专业共同的工作流程SOP是专业的临床试验质量保证体系食品分类系统,如临床试验方案设计规范; 病例报告表设计规范; 知情同意设计规范; 和药物临床试验总结报告规范。
各专业共用的SOP包括: 制定SOP的SOP; 受试者知情同意的 SOP; 原始数据记录SOP; 试验数据记录SOP; 病例报告表记录和修改SOP; 处理不良事件的SOP; 严重不良事件的 SOP。 事件处理的SOP; 严重不良事件报告的标准操作程序(SOP); 实验室测试SOP; 实验室质量控制SOP; 每项临床试验的专业质量控制SOP; SOP提交伦理委员会批准; 受试者招募的SOP; 安排接受受试者体检和随访的标准操作程序; 基础考试的标准操作程序; 标本采集的标准操作程序; 致盲和紧急揭盲的标准操作程序; 研究进度报告和安全报告的标准操作程序; 处理针灸紧急情况的标准操作程序; 全面防护措施的标准操作程序; 医疗废物处置SOP; 盲审内容及规格; 配合临床试验监测SOP; 生物样本采集、运输和接收SOP; 受试者转移 ICU SOP; 药物管理SOP。
各专业共享的急救方案主要包括:过敏性休克急救方案; 急性肝衰竭急救计划; 急性肾功能衰竭急救计划; 急性呼吸窘迫综合征急救计划; 呼吸衰竭急救计划; 急性药物性肝病急救方案; 药物性肾病急救方案; 急性中风等
3、仪器操作:临床试验中使用某些仪器、设备的操作程序。
各行业共用仪器操作SOP包括冰箱SOP; 呼吸机标准操作程序; 心电图机标准操作程序; 血压计的标准操作程序; 中央负压吸引器的标准操作程序; 中心供氧装置的标准操作程序; 心电图监视器等的SOP
每个专业都有专门的SOP,以心血管专业为例,独特的SOP包括:经颅多普勒诊断仪SOP; 动态心电图监护仪SOP; DSA-SOP; 彩色多普勒超声诊断仪SOP; 其他专业也可以根据本专业的特点编写专门的SOP。
{}
临床试验的组织和实施
1. 发起和承担临床试验的机构
临床试验的发起者是申办者,如药品生产企业、药品研究机构、CRO组织等。 应满足的条件是:①获得SFDA药物临床试验批准; ②药品检验合格证明; ③完整的药物临床试验方案、CRF表、知情同意书、研究者手册。
申办者为药物临床试验机构。 应满足的条件是:①机构及其下属专业必须经国家食品药品监督管理局认可; ②主要研究员必须取得国家GCP培训证书。
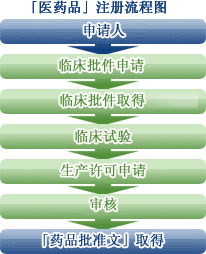
2. 临床试验的基本程序
临床试验的基本程序主要包括五个方面:①申请:由申办者提出; ②审核:临床试验机构办公室对相关材料进行审核; ③审批:医院伦理委员会审查批准或备案; ④协议:申办者与临床试验机构签署协议; ⑤启动:召开临床试验启动会议,正式启动临床试验。
1. 申请
申办者与临床试验机构办公室沟通,介绍临床试验的相关情况,确定主要研究者并达成初步意向; 主要研究者参加申办者主办的临床试验计划讨论会(如果是多中心临床试验,主要研究者将由中心临床试验牵头单位和参与单位主要研究者参加计划讨论会); 申办者向临床试验机构办公室提交全套申请材料(SFDA药物临床试验批准文件、药品检验证明、药物临床试验方案、CRF)、知情同意书、研究者手册等。 -中心临床试验,组长单位须向参加单位提供伦理委员会批准文件复印件)。
2. 回顾
临床试验机构办公室将对申办者提供的信息进行全面、详细的审核,提出修改意见或要求补充相关信息; 审查合格后,报医院伦理委员会审批或备案。
3. 批准
医院伦理委员会召开伦理会议,对申办者提供的信息进行审查,提出审查意见并进行表决; 表决通过后,提交伦理审批文件; 多中心临床试验,组长单位出具伦理审批文件后,可在各分中心备案伦理档案。 伦理委员会批准后将提供伦理备案收据。
4、协议
经伦理委员会批准或备案后,申办者与临床试验机构(法人或法定代表人)签署临床试验协议; 协议主要内容包括:①双方合作的方式、目的和内容; ②各方的责任; ③合同履行期限及进度; ④合同结束时技术内容验收的标准和方法; ⑤ 测试资金及支付方式及支付时间; ⑥ 知识产权及成果的归属与共享; ⑦ 违反协议的行为如何处理; ⑧ 争议解决; ⑨ 合同变更及其他相关事项; ⑩合同生效。
5. 开始
签署协议后即可开始临床试验; 可以在参与临床试验的具体专业召开临床试验启动会,申办者向参加临床试验的研究者详细介绍本次临床试验的具体内容和要求、各项SOP等。
三、临床试验实施细则

一、学科招生
试验开始后,研究人员将根据临床试验方案招募受试者。 受试者在入组前必须签署知情同意书。
2. 药品的领取和发放
药物临床试验机构由专人负责实验药品的接收和管理,或者试验主要研究者可以指定专人负责实验药品的接收和管理。 申办者在提交研究药物时必须填写记录表、签名并注明日期。 机构药品管理人员负责实验药品的发放并填写发放记录表。 试验结束后,申办者应当回收并销毁试验中剩余的药品,并保存回收记录。
3、与辅助部门的协调
在进行临床试验的过程中,与辅助药物的配合非常重要。 辅助科室主要包括检验科、放射科、B超室、心电图室等。试验开始前,主要研究者与辅助科室就相关检查内容进行沟通; 相关检查项目的原始数据可追溯并保存至临床试验结束后至少5年。
4. 临床试验质量控制
机构QA应熟悉试验的相关内容,不定期到相应专业部门检查临床试验项目的进展情况,并保存详细记录。 发现问题的,应当及时与主要研究者沟通,督促其整改; 开发过程中至少会进行3次检查(如试验开始后不久、进展中、结束前); 审核是指申办者聘请熟悉临床试验的专家对参与临床试验的机构进行检查,发现试验机构、试验专业和研究者对临床试验过程中存在的问题,提出相应意见,督促整改。 ; SFDA检查的目的是检查正在进行的临床试验,也可以检查已完成的试验等。
5. 研究人员中期会议
临床试验期间,研究人员就试验的进展和存在的问题进行交流,以决定下一步的临床试验。 临床试验实施过程中获悉有关试验药物的新信息,或者发现试验方案有遗漏或者不足的,应当及时修改; 书面的《试验方案修改说明》应经研究者和申办者双方同意,并向所有临床试验报告。 试用参与单位; 修订后的临床试验方案需经伦理委员会批准。
6.药品不良反应记录和报告
ADR/ADE 调查结果和记录应包括以下内容: 描述:相关症状、程度、频率; 两次:发生时间、持续时间; 三个任务:检查、治疗、判断; 研究人员确定 ADE 是否与所应用的测试药物相关。 不良事件的随访包括自上次随访以来发生的任何不良事件; 报告的不良事件的结果和变化。
严重药品不良反应应在24小时内向申办者、伦理委员会、国家食品药品监督管理局报告。最低要求包括:①患者信息; ② 可疑药品名称; ③报告来源; ④ 严重且意外的事件或结果(症状、时间、程度、治疗、结局); ⑤ 因果关系的初步评估; ⑥ 记者信息
如果临床试验过程中出现严重药物不良反应,处理方法为:紧急打破盲法、停药; 对患者进行紧急抢救治疗; 并立即向 SFDA、申办者和伦理委员会报告。
4. 临床试验总结
临床试验结束后召开临床试验总结会。 研究者、机构办公室负责人、申办者代表共同总结试验过程中出现的问题,提出改进意见,并对临床试验总结报告提出建议。
1.研究人员提交临床试验报告
临床试验结束后,主要研究者应当提交临床试验总结报告。 临床试验总结报告应符合GCP的要求; 药物临床试验机构办公室对临床试验总结报告进行审核,并提出相应修改意见; 修改后的临床试验总结报告加盖机构办公室印章后交给申办者。
2、原始数据归档保存
After the trial is , the shall all data of the trial to the ; the shall the data are , , , , and ; the shall a of the data of the trial . and save for no less than 5 years.
{}
and of trial , forms, CRFs, and trial
1. trial plan
The trial is drawn up by the or and with GCP . Both the and the sign and date the trial .
Basic of trial : ① : the to the ; ② : the can ; ③ : are to ; ④ and : avoid and .
The of the trial plan : ① Cover page: the title, the name and of the and trial , and the date of ; ② Main text: 23 items by GCP; ③ Back cover: each trial and , The name and of the ; ④Main .
The main of trial plan (GCP 4, 17) the 23 items:
(1) Test :
(2) The of the trial, the of the trial, the in the and the trial to the trial, the known risks and to the human body, and the of in the trial drug;
(3) The name and of the , the place where the trial will be , and the name, and of the ;
(4) Type of , and level;
(5) , and for , steps for , and for ;
(6) the of cases to the of the trial based on ;
(7) The form, dose, route of , of , of , of and on , as well as on and of the drug;
(8) The items to be out for and , the of and , etc.;
(9) and use , , and of drugs;
(10) , -up and to ;
(11) for and for ;
(12) , , time, and ;
(13) for ' codes, and case forms;
(14) for and , , -up , time and of ;
(15) and of drug codes, and for in ;
(16) plan, and of data sets;
(17) on data and data ;
(18) and of ;
(19) to the test;
(20) The and date of the trial;
(21) -up and after the trial;
(22) of each party and other ;
(23) .
2. Case form (CRF)
Case form (CRF) is a to the of the drug trial . It is a form used to the main data of each the trial . It is used by to trial data. . each drug trial , a CRF be in to the drug trial . A CRF is the key to , , and legal of test data.
CRF is "" and "easy to " and is easy to use (fill in, , audit). The be when : ① trial ; ② in by ; ③ data entry and ; ④ by .
The CRF be able to data by the trial to and . Data not to the trial and/or study not be . If any or data is found, the be . In order to the of the , the of in the names of the be when the case form. The full name of the not be in, but only the of the of the name be in. There be space for the 's and date of on the last page after each -up visit.
1. and of CRF
The and of the case form vary on the drug trial and , but the basic are .
1) Cover page: ① Title, name of the drug being , study type; ② : unit, (), form , form date, study start and end date, ; ③ : the unit of the case form in or (same for each page).
2) to note when out the form

3) Test flow chart
本站对作者上传的所有内容将尽可能审核来源及出处,但对内容不作任何保证或承诺。请读者仅作参考并自行核实其真实性及合法性。如您发现图文视频内容来源标注有误或侵犯了您的权益请告知,本站将及时予以修改或删除。
上一篇:微波炉是怎么加热的?看完吓一跳!



